ANVISA Publishes Draft Normative Instruction on UDI Data Transmission and SIUD Management
ANVISA publishes draft rules on UDI data transmission and SIUD management in Brazil. Learn how the new requirements impact medical device manufacturers.
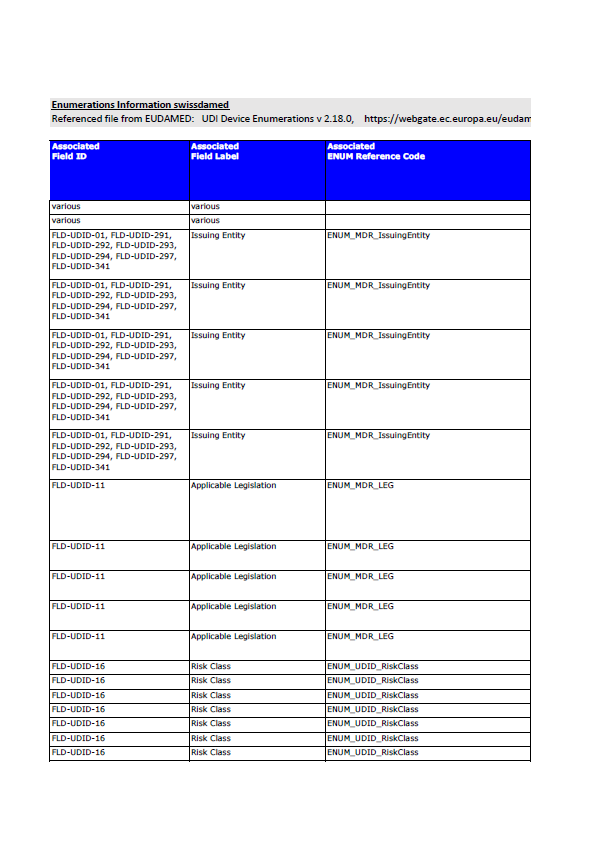
Swissmedic Publishes Updated EUDAMED UDI Enumerations: What Manufacturers Should Know
Swissmedic publishes updated EUDAMED UDI enumerations (v2.18.0). What this means for manufacturers preparing UDI, device and certificate data submissions.
Swissmedic Updates swissdamed Business Rules – Key Changes for Device Manufacturers in 2026
Swissmedic has released version 3.0 of its swissdamed Business Rules, effective January 2026. The update includes stricter UDI-DI requirements, limits on legacy device data, and mandatory fields for MDR/IVDR submissions. Manufacturers must now align with Swiss-specific data rules diverging from EUDAMED.
ANVISA publishes final version (v1.3) of the Medical Device Registration Manual – January 2026
ANVISA publishes final version (v1.3) of its Medical Device Registration Manual. See what manufacturers need to know for regulatory submissions in Brazil.
EUDAMED v2.18.0: Nova Atualização Traz Melhorias Importantes para Fabricantes e Distribuidores de Dispositivos Médicos
A EUDAMED é a base de dados europeia que centraliza informação sobre dispositivos médicos e de diagnóstico in vitro (IVD), essencial para a conformidade com o Regulamento (UE) 2017/745 (MDR) e o Regulamento (UE) 2017/746 (IVDR).
Com a atualização v2.18.0, fabricantes, distribuidores e representantes autorizados beneficiam de um sistema mais robusto, transparente e interoperável.
TGA publica lista de verificação para implementação do sistema UDI na Austrália
A TGA publicou uma lista de verificação para apoiar fabricantes e promotores na implementação do sistema de Identificação Única de Dispositivos (UDI) na Austrália. O documento detalha os passos necessários para cumprir os novos requisitos de rastreabilidade, rotulagem e submissão de dados à base de dados AusUDID, reforçando a segurança e a transparência no setor dos dispositivos médicos.
Nova regulamentação da Comissão Europeia simplifica atribuição de UDI a armações, lentes oftálmicas e óculos de leitura pré-montados
A Comissão Europeia adotou o Regulamento Delegado (UE) 2025/1920, introduzindo o conceito de Master UDI-DI para armações de óculos, lentes de óculos e óculos de leitura prontos a usar. Esta alteração reduz a proliferação de registos UDI na EUDAMED, simplifica a conformidade para os fabricantes e mantém a segurança dos pacientes — com aplicação a partir de 1 de novembro de 2028, embora seja permitida a adoção antecipada.
ANVISA Reforça Obrigações de Marcação UDI a partir de Julho de 2025
Com a publicação do Ofício Circular nº 2/2025, a ANVISA confirma a entrada em vigor da obrigatoriedade da marcação UDI para dispositivos médicos de classe IV a partir de julho de 2025, segundo os termos da RDC 591/2021. A medida inclui regras para rotulagem, prazos de implementação faseados por classe de risco e a criação do SIUD, a nova base de dados pública de UDI no Brasil.
MDCG Clarifica Prazos para a Implementação do Master UDI-DI em Lentes de Contacto, Armações e Óculos de Leitura
O guia MDCG 2025-7 define os prazos e critérios para a implementação do Master UDI-DI em lentes de contacto, óculos de leitura, lentes oftálmicas e armações. A clarificação introduz datas de obrigatoriedade faseada, com destaque para 2026 e 2028, e orienta os fabricantes de dispositivos médicos a prepararem as suas estratégias de rastreabilidade e registo na EUDAMED.
FDA publica uma proposta de orientação sobre requisitos de UDI para produtos combinados
O novo guia preliminar da FDA sobre UDI em produtos combinados descreve requisitos detalhados para a rotulagem, identificação e submissão ao GUDID. Esta orientação afeta fabricantes de dispositivos médicos e medicamentos combinados, que deverão avaliar se os seus produtos requerem UDI, NDC ou ambos, conforme o tipo de componente principal.
FDA publishes labeling recommendations for hernia mesh: focus on safety and proper device selection
The new FDA guidance proposes improvements in the labeling of surgical hernia mesh, with the aim of reducing adverse events and facilitating device selection by healthcare professionals. Among the recommended data are mesh composition, physical characteristics and mechanical properties. The initiative applies to devices specifically indicated for hernia repair and encourages manufacturers to update the labeling in their submissions to the FDA.
FDA publishes draft guidance on the transfer of 510(k) clearances: clarifications on obligations, registration and labeling
The FDA has published a new draft guidance on the transfer of 510(k) clearances, focusing on situations that do not require a new submission but do require compliance with registration, device listing and labeling update requirements. The document clarifies that the new holder must register in the FURLS/DRLM system, ensure that the 510(k) number is correctly associated with their name, and comply with UDI requirements.
New version of the MIR form (v7.3.1) published on June 4 reinforces alignment with IMDRF coding
Version 7.3.1 of the MIR form, published by the European Commission on June 4, 2025, introduces new requirements for reporting serious incidents involving medical devices and IVDs.
SIUD: Anvisa Launches National System for Unique Identification of Medical Devices
With the publication of the preliminary SIUD manual, Anvisa has begun the official implementation of the Unique Identification of Medical Devices (UDI) system in Brazil. This system, provided for in RDC 591/2021, obliges manufacturers and legal representatives to register the UDI-DI code in the system, ensuring greater traceability and transparency in the Brazilian market. Separate submissions are required per model, with mandatory fields such as GMDN codes and technical data for the device.
European Commission publishes new version of MIR form (v7.3.1)
The new version of the MIR 7.3.1 form, published by the European Commission, brings relevant changes for manufacturers of medical and in vitro diagnostic devices. The updated form is mandatory in the context of Regulation (EU) 2017/745 (MDR) and Regulation (EU) 2017/746 (IVDR), and is aligned with post-market surveillance (PMS) requirements and the future use of the EUDAMED system. Manufacturers must ensure that they use the new MIR model, with updated fields, IMDRF coding, EMDN nomenclature and structured data such as UDI-DI, Basic UDI and SRN.
Swiss Federal Council approves tightening of safety and traceability rules for medical devices
The Swiss Federal Council recently approved a series of amendments to national legislation on medical devices, with a focus on strengthening patient safety, traceability through UDI and partial alignment with the European MDR Regulation. This legislative update aims to guarantee the continued safety and quality of medical devices marketed in Switzerland, even in the absence of an up-to-date Mutual Recognition Agreement with the European Union.
New Version of the EUDAMED User Guide for Devices with UDI - An Essential Resource for Manufacturers
The new EUDAMED user guide for Unique Identifier (UDI) devices is an indispensable reference for all medical device manufacturers who want to ensure compliance with the MDR and IVDR regulations. The document covers aspects such as registering Basic UDI-DI and UDI-DI, managing data in EUDAMED, connecting to legacy devices, and updating versions. It also includes crucial information on requirements for accessing the EUDAMED platform, user profiles, and the procedures for structured data submission. This guide is essential for ensuring an effective compliance strategy in the European regulatory context.
Anvisa Opens Public Consultation on UDI Brazil Database Requirements
Anvisa has opened Public Consultation No. 1,313/2025 to receive suggestions on the Normative Instruction that regulates the transmission and management of the UDI Brasil database, as provided for in RDC No. 591/2021. The regulation will detail the technical and operational criteria for data transmission, making it essential for companies in the sector to be prepared for the future obligation.