Comissão Europeia lança consulta para revisão direcionada do MDR e IVDR
Objetivo é simplificar processos, reduzir encargos e reforçar a previsibilidade regulamentar sem comprometer a segurança dos pacientes
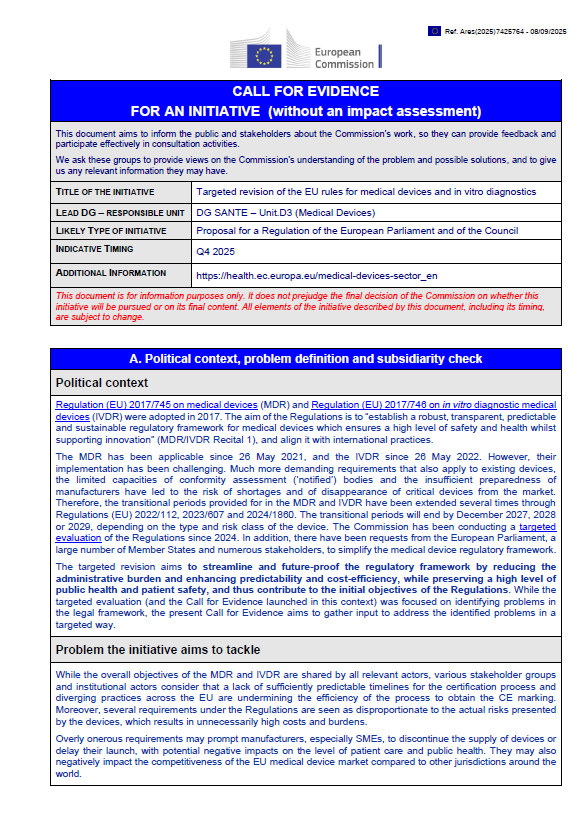
A Comissão Europeia anunciou, em setembro de 2025, uma Call for Evidence relativa à revisão direcionada do Regulamento dos Dispositivos Médicos (MDR) e do Regulamento dos Dispositivos Médicos de Diagnóstico In Vitro (IVDR). O objetivo é recolher contributos de fabricantes, autoridades, profissionais de saúde, associações de pacientes e outros intervenientes sobre possíveis alterações ao quadro regulatório europeu.
Contexto da iniciativa
O MDR está em vigor desde maio de 2021 e o IVDR desde maio de 2022. Apesar de terem reforçado a segurança e a transparência, a sua implementação revelou desafios significativos:
Exigências mais rigorosas, também aplicáveis a dispositivos já existentes.
Capacidade limitada dos Organismos Notificados, resultando em atrasos na certificação.
Dificuldades de preparação por parte de fabricantes, em especial PME.
Risco de escassez ou retirada de dispositivos essenciais do mercado europeu.
Para mitigar estes problemas, os períodos transitórios foram já prorrogados através de diferentes regulamentos (2022/112, 2023/607 e 2024/1860), com prazos que terminam entre dezembro de 2027 e 2029.
Principais objetivos da revisão
A revisão direcionada pretende:
Reduzir a carga administrativa, incluindo obrigações de reporte.
Aumentar a previsibilidade e eficiência dos processos de avaliação da conformidade.
Tornar os requisitos mais proporcionais, sobretudo para dispositivos de baixo e médio risco ou destinados a necessidades específicas de pacientes.
Acelerar a digitalização e simplificar procedimentos de governação.
Apoiar a competitividade da indústria europeia, promovendo maior harmonização internacional.
Impacto esperado para os fabricantes
Se concretizada, esta revisão poderá trazer benefícios económicos significativos, reduzindo custos de conformidade e permitindo que um maior número de dispositivos chegue ao mercado de forma mais célere. Isto aumentará a competitividade do setor europeu face a outras jurisdições, sem comprometer os elevados padrões de segurança e saúde pública.
Próximos passos
A Call for Evidence está aberta a contribuições em qualquer língua oficial da UE, através da plataforma Have Your Say, e será complementada com consultas direcionadas, incluindo inquéritos, workshops e reuniões com partes interessadas. O abordagem recairá em especial nas PME que enfrentam maiores dificuldades com o atual quadro regulamentar.
Na Smart MDR, acompanhamos de perto este processo e apoiamos fabricantes na adaptação às evoluções legislativas, garantindo conformidade, previsibilidade e acesso sustentável ao mercado europeu.